多烯(polyenes)结构是一类广泛存在于生物化学过程中的结构单元。在这些生物化学过程中,烯烃的顺反构型具有非常重要的意义,顺式和反式烯烃代表了不同的信息,进而能调控不同的生化过程。
其中最经典的例子就是视黄醛与视觉的关系——通过视黄醛这种烯烃分子顺反构型的改变,生物能够对外界光线做出反应,这也成为生物具有视力的生物学基础。尽管多烯分子在药物分子和材料领域中非常重要,但是要想高立体选择性地合成这些分子仍颇具挑战。
美国伊利诺伊大学香槟分校的Burke课题组通过迭代Suzuki偶联反应,可以快速地合成单一固定构型的共轭多烯,但是要依靠已有烯烃的立体化学,并不能合成原料烯烃的异构体。在生物化学中,通过酶催化的立体发散性生物合成或者异构化过程,可以将不同的烯烃结构单元高选择性地连接起来,进而合成许多复杂的萜烯类化合物(图1A)。
受此启发,合成化学家开发了非酶催化的类似反应,即通过一种构型烯烃的异构化来获得另一种构型的烯烃。从原子经济性和步骤经济性来讲,通过能量转移实现烯烃的异构化进而发散性合成烯烃异构体非常符合绿色化学原则,因为该过程不需要额外的当量化学试剂或合成步骤。
光驱动的烯烃顺反异构化反应历史悠久,但是这些反应往往因效率问题而被局限于苯乙烯类烯烃的异构化(图1B)。比如Hammond和Arai课题组报道了光驱动的1,2-二苯乙烯的顺反异构化,Walker课题组实现了三线态能量转移诱导的视黄醛分子的选择性异构化。
此外,Weaver课题组实现了β-位带有复杂取代基的苯乙烯的异构化。几乎同时,德国明斯特大学的Ryan Gilmour教授课题组也实现了这一转化。然而,这些反应都需要苯乙烯骨架,从而在有机合成中的应用也大受限制。于是,Gilmour课题组设想能否发展一种不受苯乙烯基团限制的方法,从而大大扩展其在合成上的应用。近日,他们报道了光驱动的β-位硼酸酯取代丙烯酸衍生物的异构化反应。该工作发表在Science 上。

Ryan Gilmour教授。图片来源:明斯特大学
整个课题的出发点来自烯烃硼酸酯与苯乙烯结构的类似性。由于烯烃硼酸酯中硼原子存在一个空的p轨道,所以作者推测该p轨道可以与烯烃的π键共轭形成一个类似于苯乙烯结构的超共轭基团,这样烯烃硼酸酯就可能产生类似于苯乙烯那样的光诱导顺反异构化。
另外,如果在烯烃硼酸酯的另一端引入一个羰基,当硼酸酯和羰基位于烯烃双键的同侧时,由于羰基氧原子上的孤对电子能与硼原子的p轨道成键,这种相互作用就会破坏硼原子p轨道与烯烃π键的共轭作用,使得整个共轭体系的前线轨道能级发生变化。这种变化可以将烯烃的顺反构型区分开,从而通过合适的催化剂来选择性地活化其中一种构型(图1C)。
在此思路下,作者选择了一个廉价的小分子光敏剂(在402 nm激发),通过Dexter-型能量转移原理,E-式烯烃硼酸酯可以被转化为Z-式烯烃硼酸酯。更重要的是,通过各种偶联反应(如Suzuki偶联、Chan-Lam偶联等),两种烯烃硼酸酯都可以进一步衍生化,进而可以合成各种立体专一的官能团化的复杂烯烃(图1D)。
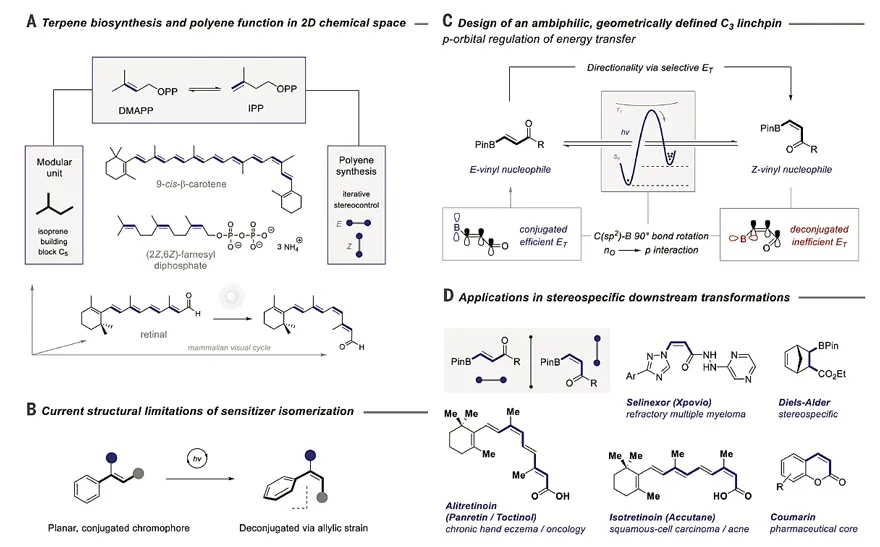
图1. 该工作及研究背景。图片来源:Science
在确定基本思路后,作者开始对反应的标准条件进行摸索。发现以噻吨酮(5 mol%)为光敏剂、乙腈为溶剂,在402 nm波长的可见光照射下,反式的2-甲基-3-硼酸酯-丙烯基酰胺(E-1,图2A)在室温下反应1 h,便能以99%的NMR收率、94:6的Z:E比转化为顺式2-甲基-3-硼酸酯-丙烯基酰胺(Z-1)。
对于标准反应,作者也进行了追踪实验研究。可以发现,反应10 min后,转化率已经超过60%;60 min后,转化率高达95%。随后,作者对该异构化反应的底物范围进行了研究(图2C)。对于β-位甲基取代的底物(E-2和E-3),反应的选择性非常优秀(> 99:1)。
除甲基外,该反应也能兼容其他大位阻的取代基,收率和选择性都非常好(E-4、E-5、E-6)。对于普通的丙烯酸仲酰胺(E-7和E-8)、丙烯酸叔酰胺(E-9)以及丙烯酸伯酰胺(E-10),都能以非常好的选择性实现异构化(up to >99:1)。虽然丙烯酸酯也能兼容该反应,但是当α-位有烷基取代基时,在硅胶色谱柱上不稳定(Z-11),从而降低分离收率。对于β-位取代的各种丙烯酸酯,均能以高收率(81%-89%)、高选择性(up to 98:2)得到相应的异构体(E-12-E-16)。
除丙烯酸酰胺和酯外,共轭烯酮也能参与该反应(E-17, 93:7)。除频那醇硼酸酯外,其他硼酸酯(如新戊基硼酸酯)也能参与该反应且选择性高(> 99:1)。另外,当丙烯酸酯或丙烯酰胺的α-位为简单氢原子时,反应的收率和选择性并不受影响(Z-19和Z-20),这样就说明了反应的选择性并非由烯烃取代基的位阻排斥作用引起的。为了进一步研究该反应的实用性,作者尝试了更复杂的底物(如糖类衍生物、薄荷醇衍生物和甾体化合物),都能以良好的收率和选择性获得目标产物(E-21-E-25)。

图2. 底物范围研究。图片来源:Science
根据作者的设想,反应的选择性不是源于烯烃取代基的位阻效应,而是源于硼原子和羰基氧原子的路易斯酸碱作用。为了验证这一假设,作者进行了对照试验。当用烯丙醚作为反应底物时(Z-26),反应的异构化产率仅有13%,这证明了底物中羰基官能团的重要性。当用不含硼原子的丙烯酸酯或丙烯酰胺时,异构化反应完全被抑制,表明了硼原子对该异构化反应不可或缺(E-27和E-28,图3A)。
为了验证该反应是否经过自由基链反应机理,作者测量了该反应的量子效率。结果表明量子效率为0.48,证明了该反应并不是一个自由基链反应(图3B)。进一步的对照试验表明,惰性气体氛围、光以及光催化剂对该异构化反应至关重要(图3C)。X射线晶体结构表明,当底物上的羰基和硼酸酯位于双键两侧时,硼酸酯和双键位于同一平面;对于异构化产物,硼原子则旋转了90 ℃,破坏了底物烯烃中硼原子p轨道与双键π轨道的共轭性,这些数据和作者的最初假设都完全吻合(图3D)。

图3:反应机理及顺反选择性研究。图片来源:Science
鉴于有机硼酸酯是合成化学中一类应用非常广泛的官能团,于是作者对产物进行了衍生化。比如,获得的硼酸酯可以转化为相应的三氟硼酸钾盐,也可以通过Suzuki偶联反应合成共轭烯烃,或者通过Suzuki偶联和酯交换串联反应来合成香豆素,还可以通过酯还原和酯交换串联反应来合成环状硼酸衍生物(图4A)。在Diels-Alder反应里,丙烯酸酯是一类活性非常高的亲双烯体,而亲双烯体的顺反构型将直接决定产物的立体化学。因此作者用该方法将E-19转化为Z-19,然后对其进行Diels-Alder反应,从而获得立体化学不同的加成产物(图4B)。
前文曾提到,复杂的共轭多烯结构在许多领域都非常重要,所以作者也用该方法合成了立体构型互补的复杂共轭多烯。从简单易得的共轭二烯36出发,分别与E-2和Z-2进行 Suzuki偶联反应,以较高的收率和选择性得到(E,Z)-37和(E,E)-37,后者经过简单的官能团转换反应得到(E, Z, E)-38和(E, E, E)-38。然后,38的两个异构体分别和Z-12和E-12发生Suzuki偶联反应和水解反应得到不同的天然产物Alitretinoin和Isotretinoin(图4C)。图4这些例子充分说明了该反应在多步合成中的实际应用价值。

图4. 反应产物的应用。图片来源:Science
总结
Gilmour教授课题组报道了可见光诱导的烯基硼酸酯的异构化反应。该反应克服了传统光驱动烯烃异构化反应的结构限制,将苯乙烯类底物扩展到应用非常广泛的烯基硼酸酯。该异构化反应的选择性来源于顺反两个异构体中硼原子p轨道的不同成键环境。在原料烯烃中,硼原子与双键共轭,而在异构化产物中,硼原子的p轨道则偏离了双键所在的平面。更重要的是,该反应的原料可以通过炔烃的硼氢化反应快速得到,反应条件简单、操作简便,同时能兼容不同的底物。考虑到硼化学的丰富性,可以预见,该反应在有机合成里将会发挥非常重大的作用。
关键词:光驱动 烯烃 顺反异构化
分享至:
![]()
![]()




鄂公网安备 42011102004299号
© 2014-2025 前衍化学科技(武汉)有限公司 版权所有 鄂ICP备20009754号-1